Calciumoxide is ongebluste kalk (gebrande kalk, lime, CaO...), een wit poeder.
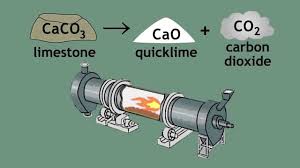 Het wordt bereid door calciumcarbonaat ((CaCO3; mineraal calciet) bv. kalksteen, maar ook (oester)schelpen, mergel, eierschalen,.. ), in een speciale kalkoven (draaitrommeloven) tot ongeveer 900°C te verwarmen, zodat het ontbindt in oxide en kooldioxide.
Het wordt bereid door calciumcarbonaat ((CaCO3; mineraal calciet) bv. kalksteen, maar ook (oester)schelpen, mergel, eierschalen,.. ), in een speciale kalkoven (draaitrommeloven) tot ongeveer 900°C te verwarmen, zodat het ontbindt in oxide en kooldioxide.
Dit heet roosten of kalk-branden.
De productie van calciumoxide is een van de oudste chemische processen die de mens toepast, mede door de overvloed aan kalksteen in de aardkorst en het gemak van de transformatie naar calciumoxide. Het gebruik ervan dateert van vóór de geschreven geschiedenis.
Afwisselend worden lagen kolengruis (of andere brandstof) en schelpen (of mergel..) bovenin de kalkovens gestort.
Na ongeveer 24 uur branden worden aan de onderzijde van de oven de schelpen er uit gehaald. Ze worden met water geblust: 2 emmers water over een kruiwagen schelpen. Daarna worden de schelpen omgespit en een extra emmer water toegevoegd. Hierdoor ontstaat een chemische reactie die voor een flinke rookontwikkeling zorgt. De schelpen vallen uiteen tot fijn poederkalk. De kalk wordt dan gezeefd.
De ongebluste kalk is niet stabiel en zal spontaan met CO2 uit de lucht reageren totdat het weer helemaal terug omgezet is in calciumcarbonaat.
Luchtkalk en hydraulische kalk
Kalk blussen doe je met water (nat blussen) of nat zand (droog blussen). In het ene geval ontstaat droog kalkpoeder, in het andere een vochtig kalkdeeg. (CaO + H2O -> Ca(OH)2)
Verschil tussen luchtkalk of hydraatkalk, en hydraulische kalk.
Luchtkalk wordt gemaakt van (zo goed als) zuivere kalksteen (CaO). Die hardt uit door CO2 uit de lucht op te nemen, waardoor opnieuw steenhard calciumcarbonaat ontstaat. De carbonatatie begint pas als de mortel droogt waardoor koolzuurgas uit de lucht toegang tot de kalk krijgt. (Niet té droog, de reactie CO2 + H2O -> H2CO3 heeft ook wat water nodig. Het kan dus zeer lang duren voor de binnenste kernen uitgehard zijn. De micro-poriënstructuur van uitgeharde hydraatkalk is veel fijner. Hydraatkalk wordt niét als bindmiddel voor mortel gebruikt. Het droogt bij contact met lucht.
Als de grondstof bestaat uit kalksteen met klei (SO3, en mineralen), ontstaat hydraulische kalk of waterkalk. De klei wordt tijdens het brandproces omgezet in silicaten en aluminaten van calcium. Hierdoor is er een luchthardend kalkaandeel en een met water reagerende hydraulische component die in een chemische reactie hard wordt zonder contact met of drogen aan lucht. Het kan als bindmiddel in mortel gebruikt worden.
Calciumsilicaten en andere oxiden zullen met water reageren tot gels en later tot structuren die verstarren en uitharden. Door deze gecombineerde reactie (hydratatie en carbonatatie) ontstaat een taai product dat vervormingen in constructies kan opgevangen.
Toepassingen met kalk
Als kalk wordt gemengd met water en zand krijg je (kalk)mortel.
Andere bouwproducten op basis van kalk zijn kalkpleister en Portland cement.
Als kalk wordt verhit met kwartszand (SiO2) en natriumcarbonaat (Na2CO3) ontstaat glas.
Als kalk gemengd met (ijzer)erts gesmolten wordt vormt het slak die niet mengbaar is met het gesmolten ijzer, zodat de silicaten kunnen worden verwijderd uit het ijzer. Ongeveer 80 kg kalk wordt gebruikt voor de productie van elke ton ijzer.
Kalk wordt ook gebruikt bij de productie van andere metalen. Bijvoorbeeld, om silicaten te verwijderen uit aluminiumoxide (Al2O3).
De papierindustrie gebruikt het in houtpulp, want kalk is zeer alkalisch, en lost de lignine op (de vezels die hout bijeenhouden).
Vóór de komst van elektrische verlichting werd witte podiumverlichting gemaakt door verhitting van kalk in de vlam van een fakkel: de eerste schijnwerpers.
Het hoge smeltpunt maakt het aantrekkelijk als een vuurvast materiaal, zoals in de bekleding van ovens.
Nog andere toepassingen:
Om haar van dierenhuiden te verwijderen.
reinigen van afvalwater
de afbraak van krengen te bespoedigen,
in de land en tuinbouw als kalkmeststof,
en om militaire rantsoenen op te warmen. Dit gebeurt zonder vuur, door de exotherme reactie met water. Het volume verdubbelt daarbij ongeveer. Je kan je ernstig verbranden.

