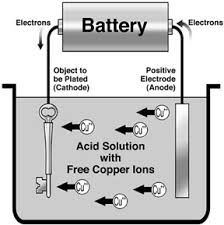
 Galvaniseren (galvano, elektroplating) is het elektrochemisch bedekken met een laagje metaal (meestal zink, nikkel, chroom) als bescherming tegen corrosie (en verfraaiing). Het basisprincipe van galvaniseren is het omgekeerde van de werking van een batterij of accu. Een zout van het bedekkend metaal (vb. zinkcloride) wordt opgelost in water en ontbindt in ionen. Het voorwerp wordt als kathode aangesloten op de – pool. (De stroombron stuurt hiernaar dus extra elektronen). Een ander metaal wordt als anode op de plus aangesloten en ondergedompeld. De opgeloste metaalionen reageren en slaan neer op de kathode.
Galvaniseren (galvano, elektroplating) is het elektrochemisch bedekken met een laagje metaal (meestal zink, nikkel, chroom) als bescherming tegen corrosie (en verfraaiing). Het basisprincipe van galvaniseren is het omgekeerde van de werking van een batterij of accu. Een zout van het bedekkend metaal (vb. zinkcloride) wordt opgelost in water en ontbindt in ionen. Het voorwerp wordt als kathode aangesloten op de – pool. (De stroombron stuurt hiernaar dus extra elektronen). Een ander metaal wordt als anode op de plus aangesloten en ondergedompeld. De opgeloste metaalionen reageren en slaan neer op de kathode.
Nikkel geeft een zeer dichte bescherming.
Chroom wordt veel gebruikt voor sanitair, vroeger ook voor auto’s en fietsen. Door de combinatie met onderliggend nikkel glanst het.
Zink wordt meestal met ijzer of nikkel gecombineerd om zinkoxide te vermijden.
Koper wordt vooral gebruikt voor printplaten, tin op blik.
Verzinken kan ook thermisch
Het werkstuk wordt in warme baden eerst alkalisch ontvet en dan met zoutzuur gebeitst.
Vervolgens gaat het door een oplossing van zout en water (ZnCl2•2NH4Cl) en dan in gesmolten zink met een temperatuur van ± 450 °C. Hierdoor ontstaat een legering.
Legeringen
Soldeer is een legering van zink met lood en tin. Het heeft een relatief laag smeltpunt en wordt gebruikt om elektrische bestanddelen, pijpleidingen… te verbinden.
Prestal heeft 78% zink en 22% aluminium, is bijna zo sterk als staal en zo makkelijk te smelten als plastic.
Zinkverbindingen
Zink oxide (ZnO) is een veel voorkomende zinkverbinding die wordt gevormd door zink en lucht. Ze vormt een coating die de rest van het metaal beschermt. Zink oxide wordt gebruikt in verf, rubber…
Zink chloride (ZnCl2) is een zinkverbinding die wordt gebruikt als houtbeschermer en insecticide.

